解决了肉体上的永生,精神上永生也许是一种惩罚/酷刑。这个问题下的一众回答,似乎没有人关心延缓衰老的研究进展,而是大家对社会的悲观预期。
回归正题,说下人类研究到哪一步了。如果一个生命体在成熟后死亡率不再增加,细胞不再衰老则可以认为它是长生不老的。一个长生不老的生物仍然可以因衰老以外的其他方式死亡,例如受伤、中毒、疾病、捕食、缺乏可用资源或环境变化。
要解决长生不老,首先得找到衰老的原因。目前人类对衰老的认知在细胞和分子水平两个方面:
衰老在细胞和组织水平上的特征包括:细胞衰老(失去增殖能力)、干细胞耗竭、营养素缺乏和慢性炎症;
衰老在分子水平上的特征包括:DNA损伤、表观遗传改变、端粒受损、蛋白质聚集、异常的线粒体/溶酶体聚集。
所以延缓衰老就是阻止或逆转上述特征的发生,延缓衰老的策略大致分为:1、系统因子(systemic factors);2、代谢调控;3、衰老细胞消融;4、细胞重编程。
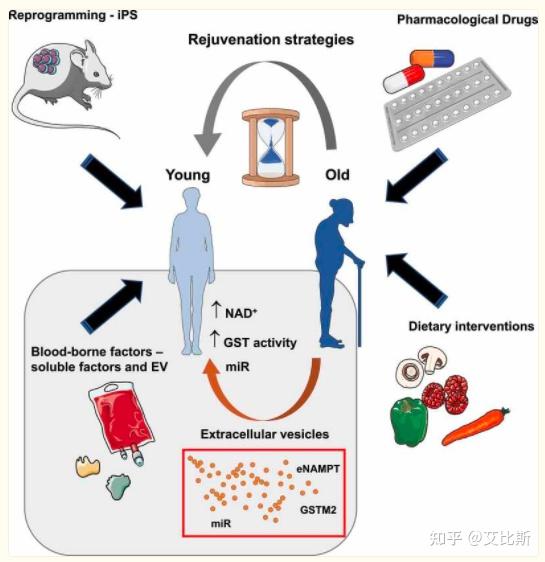
系统因子
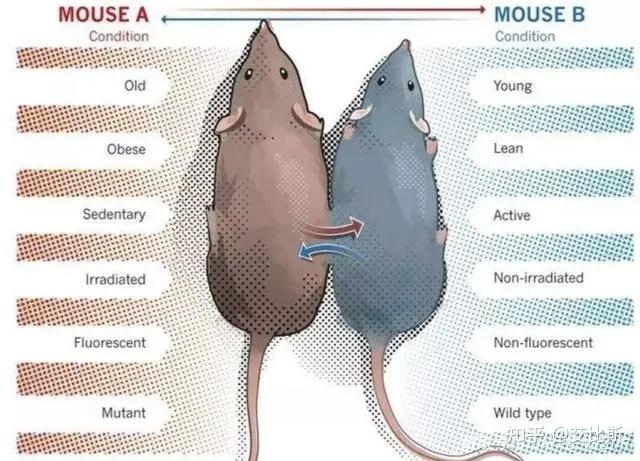
在系统因子中,血液对衰老的影响报道较多,证据也比较充分。异种共生研究(Heterochronic parabiosis)是通过手术方式将两只小鼠的循环系统进行连接,研究人员发现年轻小鼠的血液会促进年老小鼠恢复活力异,包括肌肉干细胞活力、肝脏、大脑和心脏功能,减少老年小鼠的基因组不稳定性。同时将年轻小鼠血浆注射到年老小鼠体内,也可以改善年老小鼠活力。【1-3】
除了血液外,细胞外囊泡(EV)是一种受膜保护的囊泡,含有多种蛋白质、核酸、脂质和代谢物,可以介导衰老的恢复【4】。EV可以按来源分类,可以是内吞的,也可以是直接由质膜形成的,大小在50到150纳米之间的称为小细胞外囊泡(sEV)
代谢调控
代谢调控即通过限制饮食或使用影响新陈代谢的药物要延长寿命。比如短期的饮食限制可以使多个组织的功能得到改善,包括肌肉、骨骼、肝脏、大脑、血管系统和免疫系统。周期性禁食可以延长小鼠中位数寿命、减少癌症发病及慢性炎症的发生。生酮饮食可以提升小鼠中位数寿命及减少癌症发生。这些饮食的控制与mTOR和胰岛素-IGF信号传导相关,研究影响该信号通路的相关药物对寿命的影响则成为一种研究方向,包括β-羟基丁酸、雷帕霉素、白藜芦醇、二甲双胍对寿命的影响。
当然除了上述化合物之外,研究与延缓衰老相关的还有维生素D、粪便微生物、欧米伽3脂肪酸等等【5-7】
消融衰老细胞
细胞衰老(Cellular senescence)是一种由应激诱导的细胞内在机制,可阻止受损细胞的增殖,这是在20世纪60年代,Moorehead和Hayflick在体外培养从人类供体分离的原代成纤维细胞时,他们观察到一些细胞失去增殖能力,并将这种表型称为细胞衰老。细胞衰老是诱导个体衰老的标志。
细胞衰老可由多种触发因素引起,包括端粒缩短、致癌应激、ROS和DNA损伤。进入衰老的原代细胞的主要反应是通过表达细胞周期抑制剂CDKN2A、CDKN2B和/或CDKN1A(分别编码p16INK4A、p15INK4B和/和p21CIP蛋白)诱导稳定的细胞周期停滞。衰老的另一个标志物β-半乳糖苷酶(SA-β-Gal)活性的增加。【8】
细胞间通信是指细胞之间相互通信和传递各种信息的不同方式。细胞间通讯的最佳特征是释放影响邻近细胞功能的可溶性因子。衰老细胞同样也会释放可溶性分子影响周围细胞。与衰老相关的还有分泌性炎症因子统称为SASP(senescence-associated secretoryphenotype)。
因此,理论上消除个体中的衰老细胞既可以延缓衰老。目前有两种主要的治疗策略来处理衰老和与年龄相关的疾病中衰老细胞的存在。一个是选择性杀死衰老细胞的潜力有关(使用称为衰老药物的化合物)。第二个是通过使用药物来中和细胞间通讯,特别是SASP对衰老细胞的有害影响。
通过小鼠模型,使用触发衰老细胞消除化合物表明,以衰老细胞为目标可以逆转或延缓衰老过程的各个方面。已鉴定了几种此类“抗衰老”药物,包括Bcl蛋白家族抑制剂(例如,navitoclax,也称为ABT263)、激酶抑制剂(例如达沙替尼和槲皮素)、热休克蛋白90抑制剂(例如17-DMAG)和p53–MDM2相互作用抑制剂(例如UBX0101)。
细胞重编程
细胞重编程是将已分化的体细胞转化为诱导的多能干细胞(iPSCs),例如通过转录因子OCT4(POU5F1)、SOX2、KLF4和MYC(OSKM)的表达。由衰老细胞诱导的多功能干细胞表现出端粒延长,线粒体数量改善、核形态恢复等等。
以上是目前对于人类延缓衰老的研究进展,感兴趣的话可以看以下文献。在题主的有生之年,长生不老的技术是不可能实现的。即使未来实现了该技术,受到资源的限制、人类文明的发展的限制,社会和制度是否允许这种技术的使用都是问题。
参考文献:
1、Brack AS et al. Increased Wnt signaling during aging alters muscle stem cell fate and increases fibrosis. Science 317, 807–810 (2007). [PubMed] [Google Scholar]
2. Conboy IM et al. Rejuvenation of aged progenitor cells by exposure to a young systemic environment. Nature 433, 760–764 (2005).
3、Villeda SA et al. Young blood reverses age-related impairments in cognitive function and synaptic plasticity in mice. Nat. Med 20, 659–663 (2014)
4、Yoshida M, Satoh A, Lin JB, et al. Extracellular vesicle-contained enampt delays aging and extends lifespan in mice. Cell Metab. 2019;30:329–42 e5.
5、doi: 10.21037/hbsn.2019.11.17.
6、doi: 10.3390/nu14183723.
7、DOI: 10.1097/MCO.0000000000000104
8、DOI:https://doi.org/10.1016/j.tcb.2020.05.003
9、Mahmoudi, S., Xu, L. & Brunet, A. Turning back time with emerging rejuvenation strategies. Nat. Cell Biol. 21, 32–43 (2019).
10、doi: 10.1080/15384101.2021.2013612